Nel tentativo di creare un modello della struttura atomica che
consentisse una spiegazione di tutti i fenomeni osservati, l’inglese J.J. Thomson
suggerì nel 1904 un'ipotesi secondo la quale ogni atomo era costituito da una sfera
d'elettricità positiva, in cui si trovavano immersi gli elettroni "come semi
all’interno di un frutto".

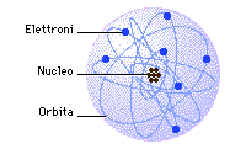
Secondo il modello di Rutherford l’atomo dovrebbe avere una
configurazione simile a quella del sistema solare: al centro dovrebbe trovarsi il nucleo
nel quale è concentrata quasi tutta la massa dell’atomo e tutta la sua carica
positiva; intorno ad esso dovrebbero ruotare, su orbite elettriche, gli elettroni, proprio
come i pianeti ruotano intorno al sole e, come per i pianeti il raggio orbitale è
stabilito dall’equilibrio tra la forza gravitazionale e quella centrifuga, così il
raggio delle orbite elettroniche, è assegnato dall’equilibrio tra la forza
d'attrazione elettrica e la forza centrifuga.
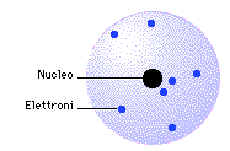
Modello di Rutherford
La meccanica quantistica risolse il dilemma: nel 1913 Bohr, ricorrendo
alla "teoria dei quanti" elaborata da Planck all’inizio del secolo.
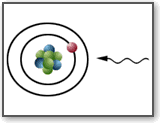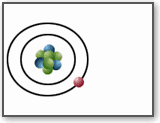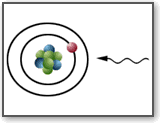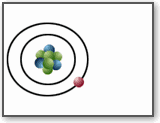
Bohr, per interpretare gli spettri di emissione e di assorbimento a righe, avanzò
l’ipotesi che gli elettroni possano ruotare intorno al nucleo solo su alcune orbite
(quantizzazione delle orbite), assorbendo ed emettendo energia secondo "quanti"
discreti E=hf (dove f è la frequenza della radiazione incidente o emessa).